Водород в природе (0,9% в Земной коре)

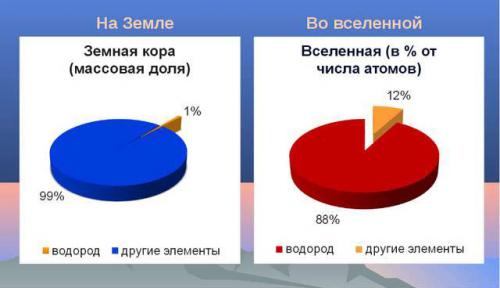
Водород (Н) очень легкий химический элемент, с содержанием в Земной коре 0,9% по массе, а в воде 11,19%.
Характеристика водорода
По легкости он первый среди газов. При нормальных условиях безвкусен, бесцветен, и абсолютно без запаха. При попадании в термосферу улетает в космос из-за малого веса.
Во всей вселенной это самый многочисленный химический элемент (75% от всей массы веществ). Настолько, что многие звезды в космическом пространстве состоят полностью из него. Например, Солнце. Его основной компонент - водород. А тепло и свет это итог выделения энергии при слиянии ядер материала. Так же в космосе есть целые облака из его молекул различной величины, плотности и температуры.
Физические свойства
Высокая температура и давление значительно меняют его качества, но при обычных условиях он:
• обладает высокой теплопроводностью, если сравнивать с другими газами,
• нетоксичен и плохо растворим в воде,
• с плотностью 0,0899 г/л при 0°С и 1 атм.,
• превращается в жидкость при температуре -252,8°С
• становится твердым при -259,1°С.,
• удельная теплота сгорания 120,9•106 Дж/кг.
Для превращения в жидкость или твердое состояние требуются высокое давление и очень низкие температуры. В сжиженном состоянии он текуч и легок.
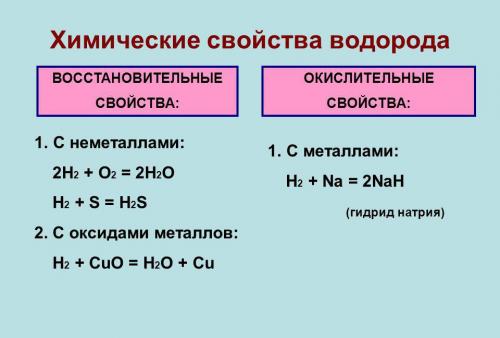
Химические свойства
Под давлением и при охлаждении (-252,87 гр. С) водород обретает жидкое состояние, которое по весу легче любого аналога. В нем он занимает меньше места, чем в газообразном виде.
Он типичный неметалл. В лабораториях его получают путем взаимодействия металлов (например, цинка или железа) с разбавленными кислотами. При обычных условиях малоактивен и вступает в реакцию только с активными неметаллами. Водород может отделять кислород из оксидов, и восстанавливать металлы из соединений. Он и его смеси образуют водородную связь с некоторыми элементами.
Газ хорошо растворяется в этаноле и во многих металлах, особенно в палладии. Серебро его не растворяет. Водород может окисляться во время сжигания в кислороде или на воздухе, и при взаимодействии с галогенами.
Во время соединения с кислородом, образуется вода. Если температура при этом обычная, то реакция идет медленно, если выше 550°С - со взрывом (превращается в гремучий газ).
Нахождение водорода в природе
Хотя водорода очень много на нашей планете, но в чистом виде его найти нелегко. Немного можно обнаружить при извержении вулканов, во время добычи нефти и в месте разложения органических веществ.
Больше половины всего количества находится в составе с водой. Так же он входит в структуру нефти, различной глины, горючих газов, животных и растений (присутствие в каждой живой клетке 50% по числу атомов).
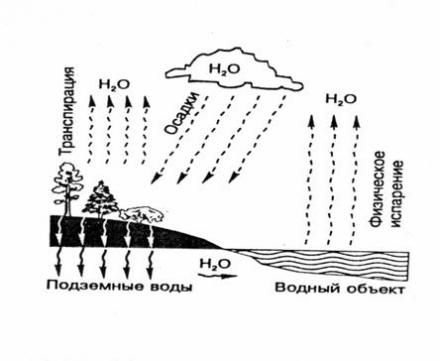
Круговорот водорода в природе
Каждый год в водоемах и почве разлагается колоссальное количество (миллиарды тонн) остатков растений и это разложение выплескивает в атмосферу огромную массу водорода. Так же он выделяется при любом брожении, вызываемом бактериями, сжигании и наравне с кислородом участвует в круговороте воды.
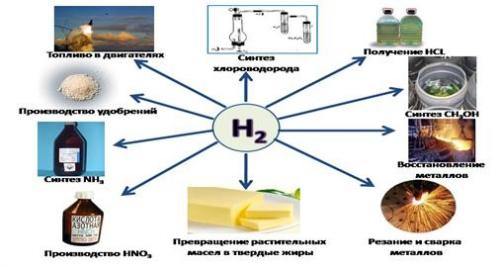
Области применения водорода
Элемент активно используется человечеством в своей деятельности, поэтому мы научились получать его в промышленных масштабах для:
• метеорологии, химпроизводства;
• производства маргарина;
• как горючее для ракет (жидкий водород);
• электроэнергетики для охлаждения электрических генераторов;
• сварки и резки металлов.
Масса водорода используется при производстве синтетического бензина (для улучшения качества топлива низкого качества), аммиака, хлороводорода, спиртов, и других материалов. Атомная энергетика активно использует его изотопы.
Препарат «перекись водорода» широко применяют в металлургии, электронной промышленности, целлюлозно-бумажном производстве, при отбеливании льняных и хлопковых тканей, для изготовления красок для волос и косметики, полимеров и в медицине для обработки ран.
«Взрывной» характер этого газа может стать гибельным оружием - водородной бомбой. Ее взрыв сопровождается выбросом огромного количества радиоактивных веществ и губительно для всего живого.
Соприкосновение жидкого водорода и кожных покровов грозит сильным и болезненным обморожением.
Комментарии
Будьте вежливы! Сообщения проверяются. Написать в редакцию сайта: обратная связь.